摘要
微卫星不稳定性(microsatellite instability,MSI)由DNA错配修复(mismatch repair,MMR)蛋白功能缺陷导致,这一分子特征在结直肠癌和子宫内膜癌等相关实体瘤中具有重要的临床意义。目前检测MSI状态的手段包括免疫组织化学检测MMR蛋白、多重荧光聚合酶链反应(polymerase chain reaction,PCR)检测微卫星位点和基于二代测序(next generation sequencing,NGS)平台的MSI算法。本共识针对MSI的定义、临床意义及其3类检测手段各自的优势与不足展开阐述和推荐。希望专家共识的制订可大力推动恶性肿瘤MSI状态普筛工作,提高临床医师对各种检测方法的认识,从而更加准确地解读检测结果,为患者提供更优质的临床服务。
微卫星不稳定的定义
微卫星(microsatellite, MS)是指细胞基因组中以少数几个核苷酸(多为1~6个)为单位串联重复的DNA序列,又称短串联重复(short tandem repeat, STR)。DNA错配修复(mismatch repair, MMR)功能出现异常时,微卫星出现的复制错误得不到纠正并不断累积,使得微卫星序列长度或碱基组成发生改变,称为微卫星不稳定性(microsatellite instability, MSI),同时导致基因组呈现高突变表型。肿瘤中,MMR功能缺陷往往由于MMR基因(MLH1、MSH2、MSH6及PMS2)及其相关基因EPCAM的致病性突变导致,也可能由于MLH1启动子区高甲基化引起的MLH1表达缺失导致[1]。MSI现象于1993年在结直肠癌中被首次发现[2]。MSI根据程度可以被分成3类:微卫星高度不稳定性(MSI-high, MSI-H)、微卫星低度不稳定性(MSI-low, MSI-L)、微卫星稳定(microsatellite stability, MSS)[3]。MSI-H在不同癌种中的发生率存在较大差异。目前已知MSI-H发生率较高的实体瘤包括子宫内膜癌(20%~30%)、胃癌(15%~20%)和结直肠癌(12%~15%,其中Ⅳ期结直肠癌4%~5%)等[4]。
MSI状态检测方法及其对比
IHC检测MMR蛋白
MSI多由MMR蛋白表达缺失导致的MMR功能缺陷所致,故可通过检测MMR蛋白缺失来反映MSI状态。通过IHC检测MMR蛋白表达与基于DNA分析检测MSI状态是评估相同生物学效应的不同检测方法[5-6]。IHC方法采用分别针对MLH1、MSH2、MSH6及PMS2的特异性抗体,阳性表达定位于细胞核。如肿瘤样本中4个MMR蛋白均阳性表达,则为错配修复功能完整(proficient mismatch repair, pMMR);任一MMR蛋白缺失即为dMMR。
多重荧光PCR毛细管电泳法检测MSI
直接检测MSI状态的常用方法是多重荧光PCR毛细管电泳法,这也是当前公认的MSI检测“金标准”。当前市面上存在多个基于PCR平台的MSI检测商用试剂盒,但国内此类试剂盒尚未获得国家药品监督管理局(National Medical Products Administration, NMPA)批准。此类试剂盒设计原理均基于美国国立癌症研究所(National Cancer Institute, NCI)建议的MS位点[并进行微调和(或)扩展],将肿瘤细胞与正常细胞的PCR法检测结果进行比较,以确定肿瘤细胞的MSI状态(有关PCR法检测MS位点及其判读的介绍详见附录1)
《CSCO结直肠癌诊疗指南2018版》建议采用NCI推荐的5个MS位点(BAT-25、BAT-26、D2S123、D5S346和D17S250)进行MSI检测[7]。《遗传性结直肠癌临床诊治和家系管理中国专家共识》(2018)指出,基于肿瘤组织样本的MSI检测作为可选推荐,建议在有条件的医疗单位开展[。
二代测序(next generation sequencing, NGS)检测MSI
近年来,随着高通量测序平台的广泛应用,NGS平台目标区域测序(即NGS panel)或全外显子组测序(whole exon sequencing, WES)/全基因组测序(whole genome sequencing, WGS)开始应用于MSI检测,使用计算工具同时研究基因组上的大量微卫星序列成为可能(当前主流NGS-MSI算法原理详见附录2)。2018年ESMO年会上,ESMO精准医学工作组(ESMO Precision Medicine Working Group)推荐将NGS作为MSI的二线检测方法(second line testing)。NCCN结直肠癌临床实践指南亦指出,MSI检测可通过经验证的NGS panel进行,尤其是对于那些需要同时检测RAS/BRAF突变状态的转移性CRC患者。
此外,基于外周血循环肿瘤DNA(circulating tumor DNA, ctDNA)的MSI(MSI from blood ctDNA, b-MSI)-NGS算法亦已崭露头角,为肿瘤组织取样困难或不足的晚期实体瘤患者MSI检测提供新选择。多个血检NGS panel及其各自bMSI-NGS算法数据已经开始在国际学术会议上以摘要形式陆续披露(表 2)[39-41],但尚未在学术期刊上以全文形式发表。因此,b-MSI-NGS检测在当前不应常规推荐,仅作为缺乏组织的患者为明确MSI状态的一种替代手段。
MSI的临床意义
- MSI检测作为林奇综合征初筛手段
- MSI是Ⅱ期结直肠癌预后因子
- MSI是Ⅱ期结直肠癌辅助化疗疗效预测因子
- MSI是晚期实体瘤免疫治疗疗效预测因子
MSI检测专家共识
- 推荐意见1:所有结直肠癌患者均应进行MSI状态筛查
- 推荐意见2:晚期实体瘤患者(如胃癌、小肠癌、子宫内膜癌、尿路上皮癌、胰腺癌和胆管癌等)如考虑免疫治疗应行MSI状态检测
- 推荐意见3:MSI检测方法包括经认证的IHC、PCR和NGS方法(3种方法各有优势)
- IHC法可以直接鉴定出导致MSI-H发生的MMR缺陷基因。IHC法检测MMR蛋白表达可在多数医院的病理科完成,普及性强,且价格低廉。但该方法受判读人员的主观影响较大,存在一定的假阳性与假阴性。因此IHC的前处理务必遵循病理科相关规范,结果判断应由有经验的病理医师完成或进行双人复核,以尽可能避免个人主观造成偏倚。
- 基于样本微切割的多重荧光PCR毛细管电泳法,简便且便宜,敏感度和特异度均较好(特别是在经广泛验证的CRC肿瘤样本中),但全国能开展该项检测的病理科相对较少,且存在一定的假阴性。
- 对于需要同时检测肿瘤驱动基因和(或)治疗相关基因变异的患者,目标区域NGS是个不错的选择。NGS法可同时检测panel覆盖的驱动基因变异,包括MMR基因胚系和(或)体细胞突变,甚至TMB等分子标签。基于ctDNA样本的b-MSI检测目前正处于验证阶段,有望为肿瘤组织取样困难或不足的晚期肿瘤患者提供新的选择。但NGS单独用于MSI检测则不推荐,理由是增加经济负担和浪费资源。所有基于NGS的MSI检测应用于临床前必须进行充分的可靠性认证及临床验证。如果遇到患者同时进行IHC-MMR蛋白表达和DNA分析(PCR或NGS法)MSI状态检测且检测结果不一致的情况,可考虑采用第3种方法(NGS或PCR法)进行验证(部分专家推荐)。
PCR方法的微卫星位点选择
基于PCR方法的微卫星位点选择曾经历数次重大变迁。
- 1998年NCI推荐用于检测微卫星状态的5个微卫星位点,包括2个单核苷酸重复位点(BAT-25和BAT-26)以及3个双核苷酸重复位点(D2S123、D5S346和D17S250);判读标准为:≥2个微卫星位点不稳定为MSI-H,1个位点不稳定为MSI-L,所有位点均稳定即为MSS。
NCI的2B3D位点是通过1997年两个重要的多中心研究筛选了30多个微卫星位点最终确认的,所以几乎国外所有的指南都是基于当年的这两个研究推荐MSI的检测位点。 - 2002年修订为Pentaplex panel,包含5个单核苷酸重复位点BAT-25、BAT-26、NR21、NR24和NR27,以提高检测敏感度及特异度。
- 2006年,MSI分析系统Promega以Mono-27取代NR27,并增加Penta C和D用于样本识别,进一步提高MSI检测敏感度。
从国际上多个 MSI 的研究来看,中国人群的 MSI-H 发生率是略低于欧美人群的,约为 4.5~13.3%,提示 MSI 的发生可能有种族差异性,位点的选择需要有中国人群的临床数据支持。
「2B3D NCI Panel」在国内外都是最权威的检测标准。关于基于中国人群的多中心研究显示[1,2],「2B3D NCI Panel」敏感度高于单核苷酸 Promega Panel,提示「2B3D NCI Panel」更适合中国肿瘤患者。
比较「2B3D」 Panel 和 Promega Panel 两种 Panel 的检测结果与 MMR IHC 结果的一致性显示: 两个 Panel 的特异性相当,均为 99.1%(215/217),2B3D Panel 灵敏度为 89.3%(25/28) 高于 Promega 的 71.4%(20/28)[2]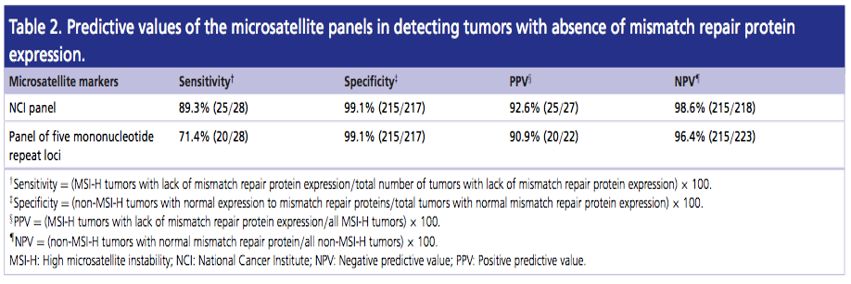
中国人群中,Zhang等纳入了近6000例MSI检测结果的Meta分析数据最终显示,2B3D位点与Promega Panel的检出阳性率在散发性结直肠癌一致(13.5% vs 12.9%),但是,如果采用其他单核苷酸Panel(6个位点的MSI Panel),检出阳性率仅7.7%!至少漏诊了30%以上的MSI-H肿瘤患者!
当前主流NGS-MSI算法原理
基于NGS的MSI检测原理分为以微卫星位点重复序列长度变化为基础以及以突变负荷和突变类型为基础。其中,基于NGS目标区域测序(targeted gene sequencing, TGS)的检测技术通常基于前者进行MSI检测。此类MSI检测的技术核心包括选取最有效的微卫星标志位点组合以及构建合理的分类模型用以最大程度区分MSI-H和MSS状态下微卫星位点重复单元长度变化水平的差异,使得MSI检测敏感度和特异度达到最优,并保证在低肿瘤占比样本中检测的稳健性。
标志位点通常表现为在MSS状态下重复单元长度高度稳定,而MSI-H状态下高频不稳定,以保证MSI检测的最优敏感度和特异度。基于WGS和WES的研究证明,不同标志位点可能表现为癌种特异性,也可具有跨癌种普遍性2种特征,而其余大量微卫星位点高度稳定,无法为MSI-H提供有效信息,故而针对Panel的不同用途(特异性癌种/泛癌种)应选择不同的位点组合[36]。前期PCR-MSI研究表明,单核苷酸重复序列在PCR-MSI检测中敏感度更高[33]。而多核苷酸重复序列本身的多态性导致检测方法对配对正常样本具有依赖性。基于PCR法中的Pentaplex panel的5~7个标志位点组合BAT25、BAT26、NR21、NR22、NR24、NR27和MONO27被认定为PCR-MSI检测的金标准。由此该位点组合也通常在NGS panel中专门被设计和应用于MSI检测。
NGS panel的MSI算法通常通过刻画选取的标志位点不同重复序列长度对应的reads个数在MSI-H和MSS中的差异来判断位点的不稳定状态,以不稳定位点比例是否超过既定阈值来确定样本的MSI状态。位点在2种状态差异的评估方法包括:基于癌组织样本和配对正常样本不同重复序列长度对应的reads个数进行χ2检验(MSIsensor)或者距离评估(MANTIS),以及独立的基于癌组织样本评估重复序列长度的类型个数与一组基线样本(非MSI-H样本)的差异(mSINGS),或者MSS状态下主要的重复序列长度类型(peak)对应的覆盖占位点覆盖的比例在癌组织样本与一组基线样本(非MSI-H样本)的差异(ColonCore-MSI),从而评估位点的稳定状态。选取的标志位点限制为1~5 bp重复单元(如MSIsensor和MANTIS)或仅单碱基重复序列(如ColonCore-MSI)的MS位点。判断样本MSI状态的不稳定位点比例的阈值包括3.5%(MSIsensor)、20%(mSINGS)和40%(ColonCore-MSI)不等。
各指南情况
2021 年更新的 NCCN 指南将推荐 MSI 检测的适应症癌种从结肠癌、直肠癌、胃癌、子宫内膜癌扩大到了前列腺癌、胰腺癌等多个实体瘤。结直肠癌、胃癌、子宫内膜癌、小肠腺癌、胰腺癌这 5 个临床常见癌种 MSI 的发生率非常高.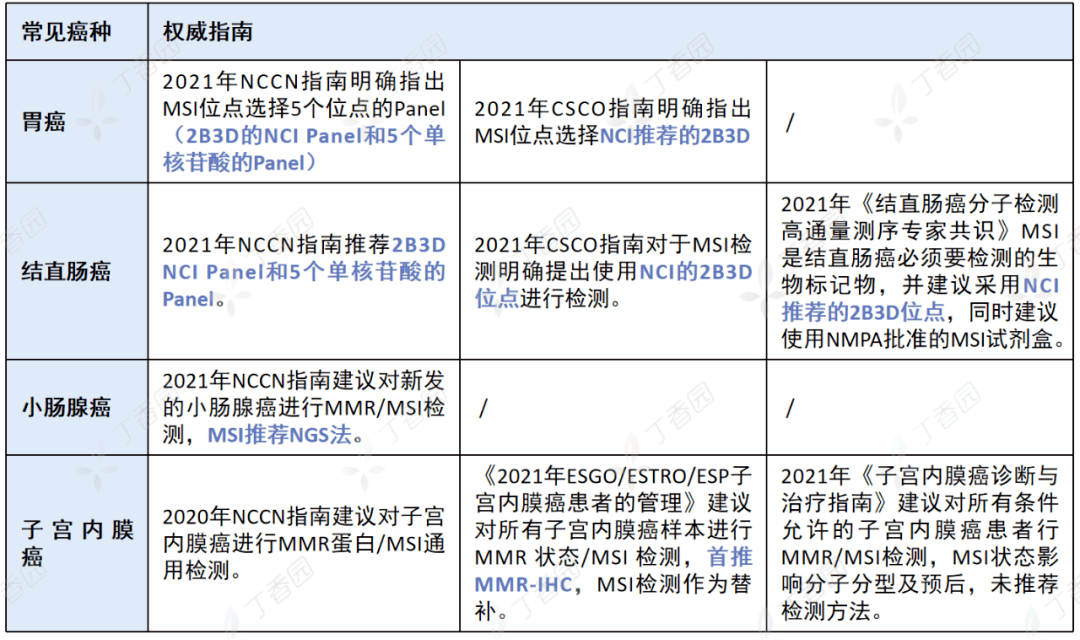
参考指南&共识
- 结直肠癌及其他相关实体瘤微卫星不稳定性检测中国专家共识
- 结直肠癌及其他相关实体瘤微卫星不稳定性检测中国专家共识
- 结直肠癌分子生物标志物检测专家共识
- Chinese Society of Clinical Oncology (CSCO) diagnosis and treatment guidelines for colorectal cancer 2018 (English version)
- (2020.V1)NCCN临床实践指南:肝胆肿瘤.bak.pdf
- (2020.V1)NCCN临床实践指南:宫颈癌.pdf
- (2020.V1)NCCN临床实践指南:卵巢癌包括输卵管癌和原发性腹膜癌.pdf
- (2020.V1)NCCN临床实践指南:前列腺癌.pdf
- (2020.V1)NCCN临床实践指南:食道癌和胃食管交界处癌.pdf
- (2020.V1)NCCN临床实践指南:胃癌.pdf
- (2020.V1)NCCN临床实践指南:子宫肿瘤.pdf
- (2020.V2)NCCN临床实践指南:结肠癌.pdf
- (2020.V2)NCCN临床实践指南:小肠腺癌.pdf
- (2020.V3)NCCN临床实践指南:乳腺癌.pdf
- 丁香园