By 赵东晓
NGS检测过程中经常遇到需要第三方验证的需求,不管是为了证明检测结果准确性,还是前期方法学检测的需求,都不可避免的需要面对各种第三方验证。
而Fish检验就是一个常用的用来检验融合的方法。最近同事对Fish进行了一些调研,简单梳理以备后用。
Fish调研
NGS报告融合推药逻辑
- 1类融合多见,为常见伴侣融合,是指南里面提到的,且有功能证据证明激活的融合亚型;
针对1类融合,相同基因,不同断点和亚型,现在药物推荐还没有区分差别。 - 2类融合少见,是指那些没有指南支持,仅有少量文献证据的罕见融合;
- 3类融合不推药;
通过FISH(荧光原位杂交)检测融合,目前有2种方法:
第1种(应用较广):可以设计已知融合基因的探针,比如针对ALK的,用红色和黄色覆盖ALK基因的上下游区域,正常就是红黄在一起,融合就是ALK发生了断裂就是红黄分开了。此方法检出的融合,不能确定是何种融合亚型,推药只能按照广义层面上的融合大类来推荐用药。
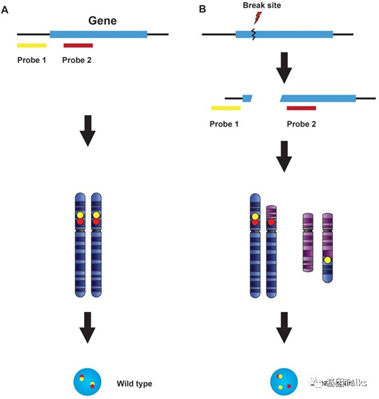
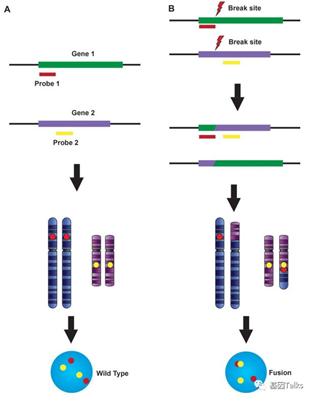
第2种(不经济实用):可以设计已知融合基因和伴侣基因的探针,比如针对ALK和EML4的,ALK全部用红色探针覆盖,EML4用黄色探针覆盖,正常就是红黄分开,融合就是红黄在一起。此方法检出的融合,为常见伴侣基因的融合,为1类融合,推药逻辑没有差异。
以ALK探针为例:Vysis ALK break-apart probe (Abbott Molecular)
美国食品药品监督管理局(FDA)已批准的FISH分离探针试剂盒(Vysis ALK Break Apart FISH Probe Kit; Abbott Molecular, Inc.)可用于检测ALK融合基因的表达。该试剂盒设计的两种探针分别标记ALK基因第20号外显子断裂点的两端,在5 ‘(着丝粒)侧有一个约442 kb的绿色探针,在3 ‘(端粒)侧有一个约300 kb的橙色探针,橙色区域包括了ALK激酶活性区。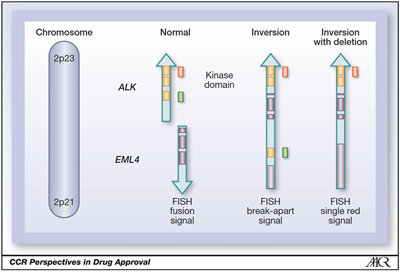
ALK基因:chr2:29,415,640-30,144,452 (GRCh37/hg19 by Entrez Gene),Size:728,813 bases.
结果判读
阴性信号:
- 一个癌细胞核内至少有一个橙色和一个绿色信号,橙色信号与绿色信号相互邻近或叠加,其问距小于两个信号直径。
- 一个癌细胞核内至少有一个橙色和一个绿色信号,有单独的绿色信号,但无相应的橙色信号。
阳性信号:
- 一个癌细胞核内至少有一个橙色和一个绿色信号,橙色和绿色信号的间距大于两个信号直径。
- 一个癌细胞核内至少有一个橙色和一个绿色信号,有单独的橙色信号,但无相应的绿色信
阳性判定:
- 计数50个肿痛细胞,若阳性肿指细胞数多于25个,该样本为阳性;
- 若阳性肿指细胞数小于5个,该样本为阴性;
- 阳性肿指细胞数介于5-25个,为可疑阳性。
需要另计数50个肿指细胞,将前后两次的合计100个肿瘤细胞的信号状况汇总。- 若阳性肿痛细胞比例少于1598(15/100),该样本为阴性。
- 着阳性肿痛细胞比例多于159(15/100,该样本为阳性。
该方法只能判断ALK基因是否断裂,可以检测所有的融合型,但不能区分与其发生融合的基因是什么。
阳性细胞为存在橙绿信号分离或单独橙色信号的细胞。
ALK基因的检测方法
ALK基因的检测方法有荧光原位杂交(FISH)、显色原位杂交(CISH)、免疫组化(IHC)、基于PCR的各种方法、NGS二代测序等。
检测ALK融合的各种技术的特点总结
参考:中国间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌诊断专家共识(2013版)
参考:Int J Mol Sci. 2019 Aug 13;20(16):3939. doi: 10.3390/ijms20163939.
总结
ALK基因融合的检测要尽可能采用两种以上的方法相互印证,以免出现漏检或假阴性结果,使得部分病友失去从靶向药中获益的机会。检测实验室应该根据组织标本类型选择合适的检测技术。当怀疑一种技术的可靠性时(如FISH的肿瘤细胞融合率接近15%时),可以考虑采用另一种技术加以验证。